細胞治療の作用機序
細胞治療とは?

細胞治療とは、人間や動物の身体を構成している細胞を体外で人工的に培養・増幅させた上で、身体に投与する治療法です。
投与された細胞が分泌する生理活性物質が、周りの環境や細胞に影響を与えることで、炎症の抑制、免疫の調整により、身体を元の正常な状態に戻そうとします。
悪い個所を叩くことが中心の化学的な薬剤とは異なり、 身体が本来持つ修復機能や自己治癒力を利用することが細胞治療の大きな特徴です。
そのため、適切なタイミングで治療を行えば、細胞治療は、病気を治すだけでなく、病気の発症を遅らせ、未然に防ぐことにも有効となり得る治療であると考えています。
間葉系幹細胞(MSC)とは?
幹細胞とは①自己増殖能と②多分化能を有する細胞のことを指します。
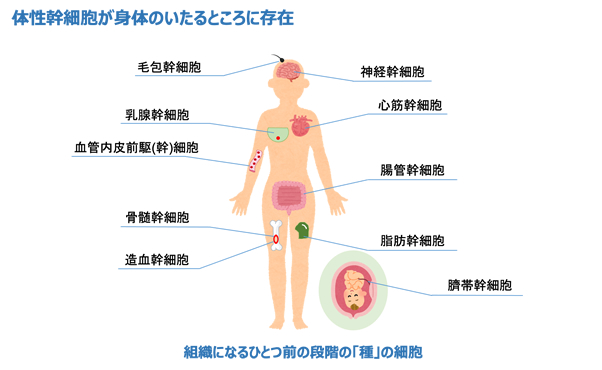
胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)が有名であり注目を集めていますが、実は体内のあらゆる組織に幹細胞は存在しています。
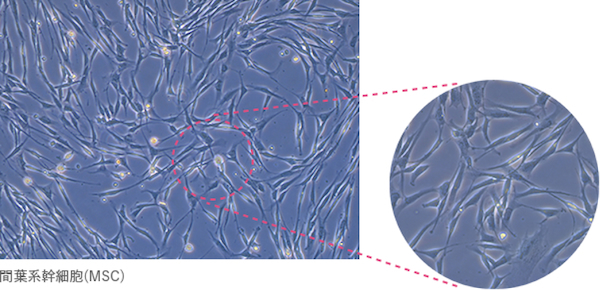
間葉系幹細胞(mesenchymal stem cells : MSC)は、骨芽細胞・骨細胞、心筋細胞、軟骨細胞、腱細胞、脂肪細胞などの中胚葉系細胞のみならず、胚葉の異なるグリア細胞や肝細胞へも分化する能力を持つ組織幹細胞です。
MSCは顕著な自己増殖能、自己複製能を有し、骨髄のみならず、臍帯血、脂肪組織、胎盤などさまざまな組織からも採取することが出来るため、組織を再生する移植治療の細胞ソースとして期待されてきました。
MSCには、胚性幹細胞(ES細胞)のような倫理的問題はほとんどなく、人工多能性幹細胞(iPS細胞)のように遺伝子導入する必要もありません。
このため、移植時の安全性の点でも優れており、取り扱いが容易なことから、ヒト医療において多くの臨床応用が認められるようになってきています。
獣医療で一般的に用いられるMSC療法では、骨髄由来や脂肪由来のMSCを使用することが多く、投与方法としては静脈内投与が用いられる場合が多いです。
一般的に、移植した他人の細胞は、移植側(レシピエント側)の免疫機能によって排除されます。
しかし、MSCは免疫細胞が認識する表面抗原であるMHC(主要組織適応複合体)クラスⅠ分子の発現が非常に低く、さらにMHCクラスⅡ分子の発現はないとされています。
すなわち、MSCはレシピエントの免疫拒絶を受けにくい性質を持っていると考えられるため、自分自身から取り出したMSCを移植する自家移植だけでなく、他人から取り出したMSCを移植する他家移植を行うことが可能となっています。
当院では主に、自社内の管理されたクリーンな環境の培養施設で、徹底した製造工程管理のもとで培養された皮下脂肪由来の他家MSCを用いて、再生医療・細胞医療をおこなっています。
間葉系幹細胞療法(MSC療法)の作用機序

MSCにはさまざまな作用があると考えられており、多様な免疫調節能力は多くの炎症性疾患の治療に利用できる可能性があります。
適応症例も多岐にわたり、自己免疫疾患、肝疾患や心疾患など多くの疾病へ応用が検討されています。
MSCは静脈内に投与されると、いったん肺にトラップされます。その後、組織の損傷や炎症などの異常部位から信号(走化性因子であるSDF-1など)が出され、これをMSCが認識(受容体CXCR4)することで、病変部位へ一部のMSCが移動する(ホーミング作用)と考えられています。
その後、病変部位へ移動したMSCは、以下の作用機序によって効果を示すと推測されています。
-
機序①:間葉系幹細胞(MSC)の分化能
MSCは、in vitroにおいて様々な細胞に分化することが確認されています。
以前は、そういった幹細胞の特性から、静脈内に投与されたMSCが身体の中で種々の細胞に分化することによって損傷した細胞に置き換わり、治療効果が得られると考えられていました。
しかし、その後の多くの研究結果により、静脈内に移植した細胞が生着することは非常に稀であり、さらに生着が認められた場合でも短期間でレシピエントの体内から排除されることが分かっています。
これらの知見から、MSCが分化して作用している可能性は否定されたわけではありませんが、静脈内投与されたMSCが効果を示すのは、MSCが生着し組織細胞に分化したためではなく、他のメカニズムによるものではないかと考えられるようになってきています。 -
機序②:サイトカイン効果
近年、幹細胞移植において、移植した細胞自体の効果はもとより、その細胞が分泌するさまざまなサイトカインが組織再生に重要な役割を果たしているという考え方が一般的になってきています。
MSCが分泌するサイトカインが周囲に存在するレシピエントの細胞に働きかけることによって、組織再生を促進するという考え方です。
以下の表に示すように、MSCは非常に多様なサイトカインを分泌することによって組織修復促進、炎症・免疫の調整を行い、治療効果を発揮します。
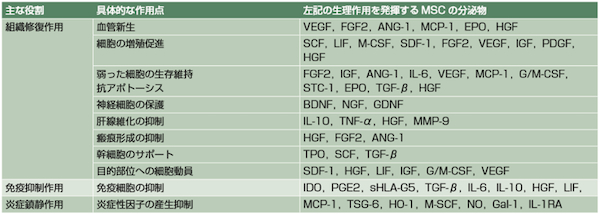
横山篤司,J-VET,2013 -
機序③:トンネリングナノチューブを介した細胞間情報伝達
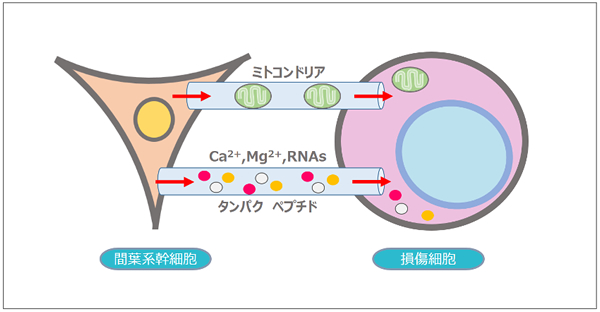
細胞-細胞間のコミュニケーションをとる方法の一つにトンネリングナノチューブがあります。
これは、脆弱な構造(アクチン)からなる細胞間を結びつける細い小管です。
このトンネリングナノチューブが一つの細胞から別の細胞にさまざまな物質を輸送していることが多くの研究によって確認されています。
静脈内投与されたMSCは、損傷した細胞の近くに移動し、トンネリングナノチューブを介してミトコンドリアを供給したり、カルシウムシグナルなどの細胞内シグナルや、細胞内タンパク質を輸送したりすることによって細胞間の情報伝達を行い、組織修復を促進すると考えられています。
-
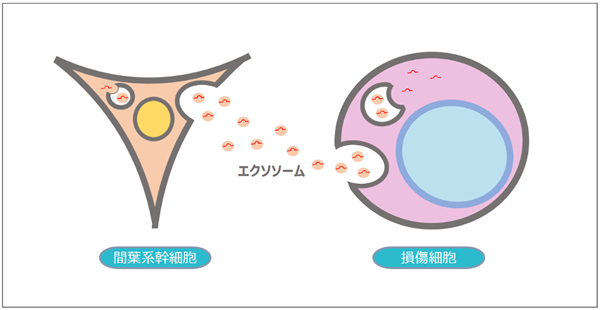
機序④:間葉系幹細胞(MSC)から分泌されるエクソソーム
エクソソームは、細胞から分泌される30~100nm程度の大きさで、脂質二重膜構造を持つ細胞外小胞の一種で、多くのタンパク質やmicroRNAなどが含まれています。
エクソソームはさまざまな細胞から分泌されていることや、血液中などでその存在が確認されていることから、遠く離れた細胞同士の情報伝達に関与している可能性が考えられています。
最近の研究では、MSC由来エクソソームがさまざまな疾患に対して治療効果を示しており、将来的にはこれらを利用した治療が可能になるかもしれません。
【自己免疫疾患・免疫介在性疾患に対する間葉系幹細胞(MSC)療法】
次のような自己免疫疾患・免疫介在性疾患は、副腎皮質ステロイドやシクロスポリンといった免疫抑制剤の他に有効な治療法がないのが現状です。
-
慢性腸症(CE)
-
免疫介在性溶血性貧血(IMHA)
-
免疫介在性多発性関節炎(関節リウマチ)
-
アトピー性皮膚炎
また、免疫抑制療法中は、しばしば感染や薬剤による細胞毒性といった副作用が問題になります。
MSCはこうした既存の治療薬とは異なるメカニズムで免疫調整作用や抗炎症作用を発揮します。
既存治療では反応の芳しくなかった症例や薬剤の副作用により治療の継続が困難であると判断される症例において、症状を快方へと向かわせることが示唆されています。
前述のとおり、MSCからは多種多様なサイトカインが分泌されることが分かっています。
MSCは病変部へホーミングした後、これらのサイトカインを分泌することにより、抗炎症作用や免疫調整作用、血管新生作用などを示すと考えられています。
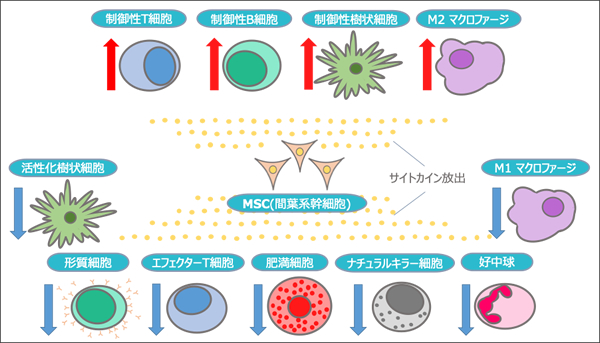
数多くの研究により、MSCはT細胞やB細胞、マクロファージや樹状細胞(DC)のような免疫担当細胞を制御する現象やメカニズムについての報告がなされています。
炎症がある際にマクロファージから分泌されるTNF-αやIL-1βや、T細胞から分泌されるINF-γなどによりMSCは、活性化し、TGF-β1、prostaglandin E2(PGE-2)、IDOなどさまざまなサイトカインを分泌します。
MSCから分泌されるサイトカインは、免疫応答を負に制御する制御性T細胞や制御性B細胞、制御性樹状細胞、抗炎症性サイトカインを産生するM2マクロファージなどの増加を促進します。
同時に、形質細胞、エフェクターT細胞、肥満細胞、ナチュラルキラー細胞(NK細胞)、好中球、活性化樹状細胞、M1マクロファージを減少・抑制させることで、過剰になった免疫応答を調節します。
このようなメカニズムから、自己免疫疾患・免疫介在性疾患に対してMSCは有効であることが示唆されています。
標準治療を行っても症状の改善がみられなかった場合、改善しても長期にわたる治療が必要となる場合、あるいは再発を繰り返してしまう場合などに、MSC療法が新たな治療の選択肢になり得ると考えられています。
脊髄損傷に対する間葉系幹細胞(MSC)療法
椎間板ヘルニアを代表とする脊髄損傷は、現在の医療技術を駆使してもその機能回復は困難であることが多く、終生の車椅子生活を余儀なくされてしまう場合さえあります。
脊髄損傷による神経機能障害は、以下の二つに分けることができます。
-
物理的な衝撃によって直接的に脊髄が損傷する一次性脊髄損傷
-
損傷周辺部より分泌される炎症性サイトカインなどにより物理的な衝撃に続発して生じる二次性脊髄損傷
脊髄損傷の症例に内科的治療を行う場合、一般的にNSAIDsや副腎皮質ステロイドを使用します。
これらは主に鎮痛・抗炎症作用によって二次性脊髄損傷の影響を最小限に抑えることを目的とした対症療法であり、根本的な治療ではありません。
脊髄の機能を完全に回復させるためには、 ・断裂した運動路や感覚路の主体をなす軸索の再生や再髄鞘化 ・ニューロンのシナプスの再形成 ・グリア瘢痕の抑制、 ・空洞の修復のすべてを達成する必要があります。
これらすべてに対する治療として、MSCによる脊髄再生医療が注目されています。
幹細胞による脊髄再生の機序には、以下の3つの機序が考えられています。
-
幹細胞による細胞の置換
-
幹細胞からの軸索の伸長と再疎通
-
サイトカインをはじめとする液性因子による組織修復効果(パラクライン効果)
以前は、MSCも神経幹細胞などと同様に、損傷脊髄に生着して神経系細胞へと分化することで脊髄が再生するのではないかと推察されていました。
しかし、MSCを脊髄損傷モデルに移植すると、移植後3~4週間以内にレシピエントの脊髄から消失することが明らかになっており、MSCそのものが神経系細胞に分化することについては否定的な意見が多くみられます。
現在のところ、MSCによる脊髄損傷の治療効果は、サイトカインをはじめとする液性因子による組織修復効果(パラクライン効果)が主体であると考えられています。
投与したMSCが脊髄の損傷部位に集積し、一度生着してさまざまな液性因子を分泌することで、脊髄の修復に寄与していると考えられています。
-
脊髄に元々存在している神経幹細胞の分化を誘導
-
ニューロンの保護、細胞外マトリックスの形成、軸索の伸長や再髄鞘化の促進
MSCによるこれらの効果は、およそ1ヶ月前後をピークに次第に消失し、その後は自己の治癒機構へと置換されていくと推察されています。
このような理由から、MSC投与による脊髄損傷の治療は、急性期から亜急性期が適用になると考えられています。
標準的な内科的治療や外科的治療を行っても歩行機能や排泄機能の改善が見られない場合や、動物の状態により外科的治療の適応が難しい場合に、MSC療法が脊髄損傷への新たな治療の選択肢になり得ると考えられています。
